中性にすることが中和?
酸性の水溶液には水素イオン(H+)が、アルカリ性の水溶液には水酸化物イオン(OH-)が含まれていると前項で説明しました。
それでは同じ体積と濃度同士の酸性とアルカリ性の水溶液を混ぜるとどのような事が起こるでしょうか?
結論から言うと「同じ体積と濃度同士だと、中性になる」です。
それでは「中和」とは何でしょうか。
「酸性とアルカリ性の液体を混ぜて中性にすることだよ」と答えてしまいそうですが、これは外れてはいませんがもう少し深く中和について理解する必要があります。
中和とは
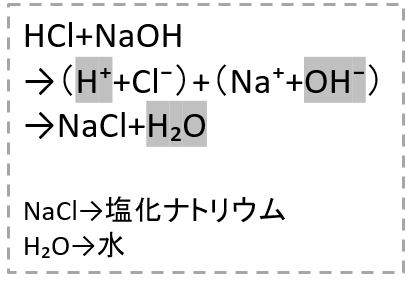
酸性の液体、塩酸(HCl)にアルカリ性の水酸化ナトリウム(NaOH)を加えたときの反応式を見てみます。
塩酸と水酸化ナトリウムを混ぜると、塩化ナトリウムと水が出来ることがわかります。
ここで注目したいのは「水素イオン」と「水酸化物イオン」が結びつくとどうなるのか?ということです。
右の式でグレー色にしてあるH+とOH-が結びつくと「水」が出来ます。
H+ + OH- → H₂O
このように、「水」が出来るのです。
つまり、中和とは、酸性の水溶液中の水素イオンとアルカリ性の水溶液中の水酸化物イオンが結びついて「水をつくる反応」
ということです。
中性になるとは限らない
「同じ濃度」「同じ体積」の塩酸と水酸化ナトリウムを混ぜる場合、できた液体は中性になります。
しかし、濃度や体積が違うと中性にはなりません。
塩酸2リッターと水酸化ナトリウム1リッターを混ぜた場合、同じ濃度であれば塩酸の方が多いので「酸性」になります。
そして、中性にならないとしても「水」はできています。
酸性とアルカリ性の液体を混ぜ、少しでも水が発生するなら、それは「中和反応」をしている、ということになります。
【pH中和処理でお困りのお客様はお気軽に】